Jardins de silicato
QUÍMICA
Jardins de silicatos
Objetivo
Observar a formação de precipitados gelatinosos.
Descrição
O silicato de sódio é um exemplo de sal de cadeia infinita chamados de pyroxenos. Nestes compostos as cadeias são paralelas umas às outras e são presas pelos cátions que estão entre elas. Obviamente a exata identidade dos cátions é de menos importância para a estrutura. Devido à força das cadeias e também à relativa fraqueza das forças eletrostáticas entre os íons dos metais, é esperado que a substância rasgue paralelamente às cadeias. Cadeia infinita de um silicato:

O ácido clorídrico por ser um ácido forte encontra-se totalmente dissociado. Os prótons provenientes de suas moléculas atacam os locais onde encontram-se os cátions de sódio. Forma-se o ácido meta-sílico ,H2SiO3, que possuí características de gel devido à presença de moléculas de água em sua estrutura. Os silicatos são preparados em laboratório pela fusão a ~1300 oC de sílica (SiO2) e o carbonato do respectivo metal alcalino. É liberado gás carbônico e é obtida uma mistura muito complexa de silicatos. Uma solução de silicato de sódio parece conter o íon [SiO2(OH)2]2- de acordo com o espectro Rama, mas dependendo do pH e de sua concentração, outras espécies são encontradas.
Em laboratório foram realizados inúmeros testes sem a obtenção da quantidade e da qualidade desejada de gel, H2SiO3, isso deve-se principalmente às condições da solução de silicato de sódio, que para a reação necessária não estava sob as condições de pH e concentração exigidas Por fim, a desidratação do ácido forma a silica-gel, SiO2. A sílica pura ocorre sob duas formas, quartz e cristobalite. O silício, com configuração tetraédrica,
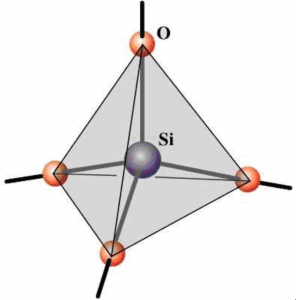
é sempre ligado a quatro átomos de oxigênio, mas as ligações têm acentuado caráter iônico. A estrutura do quartz é extremamente complicada com cadeias em forma de hélices interligadas onde a unidade básica é o SiO4. Já o cristobalite tem a seguinte estrutura:

Material
Béquer de 500mL ou um poço da boca larga;
Silicato de sódio;
Água destilada;
Bastão de vidro ou madeira;
Cristais (não pó) dos seguintes sais hidratados:
Cloreto de cobalto
Sulfato de cobre
Cloreto de ferro (III)
Cloreto de cálcio
Sulfato de níquel
Cloreto de manganês.
Procedimento
Encha um frasco até a metade com uma solução concentrada de silicato de sódio;
Complete o frasco com água e agite com um bastão de vidro ou madeira até que a solução esteja homogênea;V Adicione os maiores cristais que você encontrar de cada um dos sais;V Observe o que ocorre após adicionar cada um deles.
Análise
O silicato de sódio reage com cada um dos íons metálicos para formar um precipitado gelatinoso. Este precipitado se forma inicialmente ao redor dos cristais e funciona como uma membrana semipermeável. A concentração do sal dentro da membrana é muito maior do que do lado de fora. Desta maneira, a água tende a difundir para dentro da membrana para igualar as concentrações interna e externa. Este fenômeno é conhecido como osmose. Quando a água entra na membrana, ela irá esticar e se romper e mais precipitado se forma. O processo vai se repetindo e o jardim de silicato vai crescendo.
Observação:
Eis as cores que dão os sais dos metais utilizados:
Cálcio-branco
Cobalto – azul escuro
Cromo – verde escuro Cobre – verde/azul claro
Ferro – laranja escuro/marrom
Manganês – branco ou rosa claro
Níquel – verde.
Dicas
Se não encontrar o sal listado acima você pode substituí-lo por um outro contendo o mesmo cátion e que possa ser solúvel em água, ou seja, você pode usar cloreto de cobre no lugar de sulfato, etc.

