Apostilas sobre datação isotópica.
Como ler os relógios nucleares
“Um dia desses”, conta Dona Fifi, “meu neto Felipe me disse: ‘Vovó, você é tão velha que sua idade só pode ser medida com o carbono 14’. Santa ignorância! Se minha idade fosse medida com o método do carbono 14 ficaria evidente que sou tão nova e fresca quanto o ar de Sobral que respiro todo dia.”
Para mostrar ao neto que ele disse uma besteira, Dona Fifi escreveu as apostilas que publicamos a seguir. Nelas, nossa querida mestra ensina, com seu jeito bem-humorado, como os isótopos radioativos são usados para medir o tempo e como nos possibilitam saber a idade da Terra, das tumbas dos faraós e de seres que passaram por aqui há muitos e muitos séculos. De quebra, aprenderemos mais um pouco de física nuclear e algumas de suas aplicações.
Apostila 1: Isótopos radioativos, decaimento e meia-vida.
Espero que você já tenha lido minhas apostilas sobre a fissão nuclear e saiba o que é um isótopo radioativo. Se não leu, melhor ler agora para entender melhor o que vou contar a seguir.
Como vimos antes, quando um núcleo radioativo emite uma partícula alfa ou uma partícula beta, dá-se uma “transmutação”: o núcleo deixa de ser o núcleo de um elemento e passa a ser o núcleo de outro elemento. Esse era o sonho dos alquimistas que queriam transformar ferro em ouro. Veja, para recordar, dois exemplos de transmutação, um com emissão de uma alfa, e outro com emissão de uma beta.
No primeiro caso, voltamos ao nosso velho conhecido, o urânio-238. O urânio-238 (ou, mais simplemente, U-238) tem número atômico A=92, logo tem 92 prótons e 146 neutrons (238-92=146) em seu núcleo. Esse isótopo do urânio pode emitir uma partícula alfa. Lembre que uma alfa é uma partícula feita com dois prótons e dois neutrons. Na verdade, uma alfa é simplesmente um núcleo do elemento hélio. Portanto, quando o U-238 emite a alfa seu número atômico decresce de duas unidades e seu peso atômico decresce de 4 unidades. Nesse processo, o Urânio-238 vira Tório-234, segundo a reação:
238 U 92 ===> 234 Th 90 + 4 He 2 (alfa).
Agora, para dar um exemplo de transmutação com emissão de uma partícula beta, usaremos esse mesmo Tório-234 que surgiu na reação acima. Lembre que uma beta é simplesmente nosso velho conhecido, o elétron, com carga negativa e peso desprezível em comparação com o peso do próton ou do neutron. Emitindo uma beta, o Tório-234 vira o Protactínio-234, segundo a reação:
234 Th 90 ===> 234 Pa 91 + b-1 (beta).
Além de diferirem pelas partículas que emitem, esses dois casos também diferem, e muito, em seus tempos de vida médios, ou meias-vidas, que representaremos com a letra τ. A meia-vida do U-238 é de 4.500.000.000 anos (4,5 bilhões de anos ou 4,5 x 109 anos). Já a meia-vida do Pa-234 é de, apenas, 1 segundo!
Deixe eu relembrar o que é a meia-vida τ pois esse é um personagem importante em nosso relato.
Suponha que você tem uma amostra com N átomos de urânio-238. N normalmente é um número muito grande. Toda vez que um núcleo do U-238 de sua amostra emite uma alfa, você perde um átomo de urânio e ganha outro de tório. Pois bem: quanto tempo você terá de esperar até que metade dos seus átomos de urânio desapareça, virando tório? Resposta: τ = 4 bilhões e 500 milhões de anos! Haja paciência.
A figura abaixo ilustra o decaimento de uma amostra radioativa que começa, no instante τ=0, com N0 átomos e tem meia-vida τ.
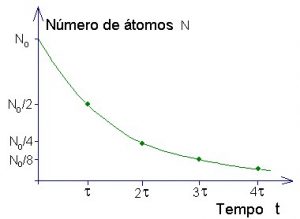
É bom você se acostumar a interpretar gráficos. Se até um economista consegue entender um gráfico, quanto mais você, pessoa esperta. Esse aí em cima mostra que, a cada tempo τ (meia-vida), o número de átomos da amostra cai para metade. Essa curva, se você não sabe, é uma exponencial. Ela é representada pela equação:
N = No e-λ t
Esse l que aparece no expoente está relacionado com a meia-vida τ do seguinte modo:
λ = Log 2 / τ
Se você é bom em matemática, verifique que isso é verdade.
De qualquer modo, basta entender o seguinte: se a gente conhece a meia vida de uma substância radioativa e sabe quanto átomos dessa substância existem na amostra em um dado instante, sabe também quantos existirão em qualquer tempo futuro. Basta traçar uma curva como essa aí em cima com os valores conhecidos.
Na próxima apostila veremos como esse conhecimento é usado nos chamados métodos de datação radioativa.
Apostila 2: Métodos de datação por isótopos radioativos.
Para iniciar, veja uma tabela com alguns isótopos radioativos que serão importantes nos próximos relatos. A primeira coluna contém os nomes desses isótopos (isótopos pais). A segunda coluna contém os nomes dos isótopos formados pelo decaimento radioativo dos primeiros (isótopos filhos). A terceira coluna dá a meia-vida dos isótopos pais, em anos.
| ISÓTOPO PAI | ISÓTOPO FILHO | MEIA-VIDA |
| Carbono-14 | Nitrogênio-14 | 5730 anos |
| Potássio-40 | Argônio-40 | 1,25 bilhões de anos |
| Urânio-238 | Chumbo-206 | 4,5 bilhões de anos |
| Rubídio-87 | Estrôncio-87 | 48,8 bilhões de anos |
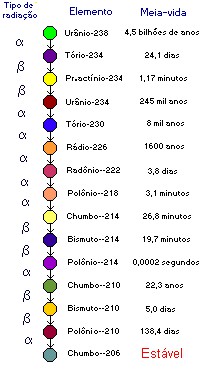
Note que o isótopo filho nem sempre surge diretamente do decaimento do isótopo pai. O chumbo-206, como vimos antes, só aparece depois de uma longa série de transformações, a partir do urânio-238. Essa série é mostrada ao lado, para sua diversão. Observe a enorme diversidade nos valores das meias-vidas. E veja que o chumbo-206 não é filho do urânio-238; é tata-tata…tataraneto!
A meia-vida do urânio-238, 4,5 bilhões de anos, é semelhante à idade de nosso planeta, a Terra. No entanto, não pense que o urânio que existe na Terra formou-se por aqui. Na verdade, ele é um extra-terrestre, originário de alguma estrela distante que explodiu. Mas, essa é outra história que talvez eu conte um dia desses.
Agora podemos ver como medir tempo usando isótopos radioativos. Como vimos na apostila anterior, o decaimento de uma amostra radioativa é representado por uma curva exponencial. No gráfico abaixo, a exponencial indica como a percentagem do isótopo pai vai diminuindo em uma amostra (uma rocha, por exemplo), enquanto outra exponencial, agora crescente, indica como a percentagem do isótopo filho vai aumentando. No instante inicial só existe o isótopo pai (100%). Depois de uma meia-vida, metade dos átomos do isótopo pai (50%) se transmutaram no isótopo filho. Depois de 2 meias-vidas, a percentagem do isótopo pai caiu para 25%, enquanto a percentagem do isótopo filho subiu para 75%.
Pronto. Se você possui uma amostra (uma rocha, por exemplo) e quer saber a idade dela, basta medir a percentagem dos isótopos pai e filho na amostra. Com o auxílio de um gráfico como esse, e sabendo a meia-vida do isótopo pai, você saberá a idade de sua amostra. Por exemplo, se sua rocha tem 75% de urânio-238 (pai) e 25% de chumbo-206 (filho), o gráfico diz que o tempo, desde que a rocha foi formada, foi de 0,415 τ, isto é, 0,415 x 4,5 = 1,87 bilhões de anos.

Esse processo, da forma que descreví, baseou-se em algumas hipóteses que nem sempre são verdadeiras. Por exemplo, admitimos que, no instante inicial, só existiam átomos do isótopo pai e nenhum do filho. Mais adiante mostrarei como proceder se essa hipótese não for cumprida. Por outro lado, espera-se que o isótopo filho, uma vez formado, permaneça na amostra. No caso do argônio-40, filho do potássio-40, essa hipótese é precária. O argônio é um gás e, como todo gás, gosta de sair pelo mundo. Assim mesmo, é muito comum encontrar o argônio preso em incrustações de uma rocha que contém potássio-40. Nesse caso, é possível fazer-se uma boa datação.
Na apostila seguinte, vamos tratar do mais famoso método de datação que existe: o método do carbono-14. Nele, o isótopo filho não vai ter importância pois o que se mede é a atividade do isótopo pai. Vamos até lá para ver como isso é feito.
Apostila 3: O método do carbono-14.
O elemento carbono faz parte de toda a matéria viva. As plantas “respiram” CO2 (gás carbônico) da atmosfera. Os animais comem as plantas e nós, monstros de escuridão e rutilância, comemos plantas, animais e respiramos o ar atmosférico.
O carbono que existe na Terra, presente no ar, nas rochas e nos seres vivos, tem três isótopos. O mais abundante é o carbono-12 (C-12): 99% do carbono na Terra é C-12. Depois vem o carbono-13, com praticamente 1% de abundância. Não sobra quase nada para o outro isótopo, o carbono-14, que é extremamente raro (apenas 0,001%), mas será o herói da presente apostila.
O C-14 é muito raro mas tem uma vantagem: dos três isótopos do carbono é o único radioativo. Antes de explicar como é a radioatividade do C-14, vamos contar de onde ele vem. O processo de formação do C-14 aqui na Terra foi explicado em 1946 pelo americano Willard Libby e acontece do seguinte modo. A atmosfera da Terra é constantemente bombardeada por partículas sub-atômicas vindas do exterior, os chamados “raios cósmicos”. Boa parte desses raios cósmicos são prótons de alta velocidade, vindos do Sol ou de locais mais ermos do universo. Esses prótons, quando atingem as camadas mais altas da nossa atmosfera, se chocam com os átomos que vão encontrando e, nas colisões, arrancam neutrons dos núcleos desses átomos. Os neutrons arrancados, por sua vez, se chocam com os núcleos dos átomos de nitrogênio da atmosfera. Lembre que o nitrogênio é o elemento mais comum da atmosfera terreste (79%); o oxigênio vem em modesto segundo lugar (21%). A reação entre o núcleo de nitrogênio (N-14) e o neutron forma o isótopo carbono-14 do seguinte modo:
14N7 + 1n0 –> 14C6 + 1H1
Em português: o neutron reage com o nitrogênio-14 (que é natural na atmosfera) formando um átomo do isótopo carbono-14 e um átomo de hidrogênio. Observe o correto balanceamento dessa equação.
O carbono-14 resultante dessa reação logo se combina com o oxigênio do ar e forma uma molécula de gás carbônico CO2:
14C + O2 –> 14CO2
O 14CO2 se dispersa no ar e, eventualmente, é absorvido pelas plantas, no processo de fotossíntese. Portanto, as plantas absorvem uma pequeníssima, porém constante, quantidade de C-14, na mesma proporção que ele existe na atmosfera. Os animais, nós inclusive, comem as plantas e absorvem a mesma proporção de C-14.
Acontece que o carbono-14 é radioativo. Sua radioatividade consiste na emissão de uma partícula beta, fazendo com que o carbono se transforme novamente em nitrogênio, segundo a reação:
14C6 –> 14N7 + b–

Willard Franck Libby
Foi aí que Libby teve a grande idéia de sua vida, que lhe rendeu o prêmio Nobel, alguns anos depois. Como descrevemos acima, enquanto o animal ou planta está vivo seu organismo contém uma pequena quantidade de carbono-14, na mesma proporção que existe em equilíbrio na atmosfera. E o que acontece quando o ser vivo morre (e passa a ser ser morto)?
Ao morrer, o ser deixa de respirar. Por conseguinte, pára de absorver carbono, tanto na forma de carbono-12 quanto na de carbono-14. Ora, o carbono-14 é radioativo e o carbono-12 não é. Portanto, depois que a planta ou animal morre, o carbono-14 presente em seu corpo vai gradualmente virando nitrogênio-14, que não é radioativo.
Desse modo, surgiu o método de datação por carbono-14, bolado por Libby. Sabemos com precisão qual é a proporção de carbono-14 em um ser vivo, planta ou animal. É a mesma que existe em equilíbrio na atmosfera. Essa proporção, no entanto, começa a mudar a partir do momento em que o organismo morre. Nesse instante, é acionado um relógio nuclear que consiste na percentagem decrescente de carbono-14 no organismo que morreu. Para saber há quanto tempo ele bateu as botas basta medir, de alguma forma, quanto carbono-14 resta em seu corpo ou parte dele.
A meia-vida do carbono-14 é de 5730 anos. Se tivermos uma amostra de madeira tirada de uma árvore que morreu há muito tempo, comparamos a proporção de C-14 nessa madeira com a proporção de C-14 em árvores vivas e, usando um gráfico exponencial como o que vimos acima, saberemos quantos anos se passaram desde que a árvore morreu. Na verdade, o método de Libby não consiste em contar, diretamente, quantos átomos de C-14 permanecem na amostra. Em vez disso, mede-se a radioatividade da amostra. É isso que veremos na próxima apostila.
Apostila 4: Algumas aplicações da datação por carbono-14.
Em vez de medir a proporção de carbono-14, o método experimental se baseia na atividade da amostra. Como vimos, ao se desintegrar, o carbono-14 emite uma partícula beta. Essa partícula beta, que não passa de nosso velho conhecido, o elétron, pode ser detectada por um contador Geiger. Esse tipo de contador todo mundo conhece do cinema: é aquele que emite um barulhinho que fica intenso quando se aproxima de alguma coisa radioativa. Cada tique daqueles é uma contagem. Na verdade, os contadores não precisam emitir nenhum som, apenas mostram um número que indica quantas partículas foram detectadas. Pois bem, verifica-se que 1 grama de carbono retirada de um ser vivo ou da atmosfera provoca, em média, 13,6 contagens por minuto. É um número pequeno de contagens mas suficiente para uma medida de boa precisão, dentro de limites que veremos a seguir. Se uma amostra, tirada de um velho pedaço de madeira, só dá 6,8 contagens por minuto, saberemos de imediato que já se passaram 5730 anos (uma meia-vida τ) desde que a árvore de onde veio essa madeira foi cortada.
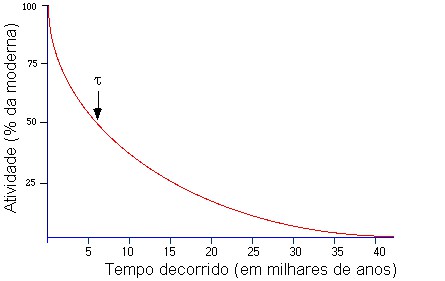
Como a atividade normal do carbono-14 é muito fraca e vai diminuindo com o tempo, caindo para a metade a cada 5730 anos, o método só é confiável para tempos equivalentes a, no máximo, umas 10 meias-vidas. Isto é, para medidas até uns 50.000 anos. Para tempos mais distantes existem outros métodos, como veremos na próxima apostila.
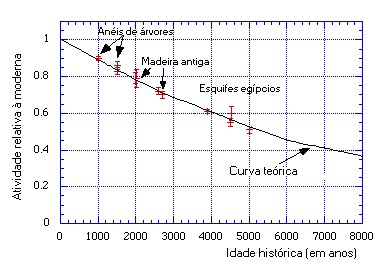
Os primeiros testes da confiabilidade do método de datação por carbono-14 foram feitos pelo próprio Libby e seus colaboradores. Eles mediram a idade de uma amostra tirada da madeira de um caixão mortuário egípcio da época do faraó Zoser. Documentos históricos informavam que esse faraó viveu 2000 anos antes de Cristo. O carbono-14 forneceu um resultado em excelente concordância com o valor histórico. Outras medidas feitas pelo grupo utilizaram amostras tiradas de árvores milenares. A idade dessas árvores pode ser estimada contando o número de anéis em seus troncos. Cada anel indica um ano. Novamente, os valores obtidos com o método do carbono-14 concordaram muito bem com os valores obtidos pela contagem de anéis. A figura abaixo foi adaptada de uma publicação de Libby e seus colegas.
Em 1947, jovens pastores beduínos, procurando por um bode extraviado, entraram em uma caverna no deserto da Judéia e acharam alguns potes cheios de velhos pergaminhos. Os arqueólogos, colegas do Indiana Jones, logo correram para o local e encontraram, nas imediações, milhares de outros fragmentos. Os pergaminhos ficaram conhecidos como os “Manuscritos do Mar Morto”, pois a região onde estavam fica perto desse mar. É óbvio que o método de datação com carbono-14 foi usado para estimar a idade desses documentos. As medidas indicaram que eles foram preparados há cerca de 2000 anos atrás, no tempo em que Cristo andava por essas paragens. O erro das medidas puxa esse tempo de uns 200 anos para frente ou para trás.

Fragmento de um manuscrito do Mar Morto.
O que dizem esses manuscritos, que estão escritos em hebreu, aramaico e grego? Na minha opinião, só papo furado. São preceitos piedosos, como fazer penitência e cânticos religiosos. Mas, como foram encontrados na região sagrada de várias religiões e datam do tempo em que, supostamente, Jesus pregava por aquelas bandas, despertaram, e ainda despertam, muita curiosidade dos especialistas e do público em geral.
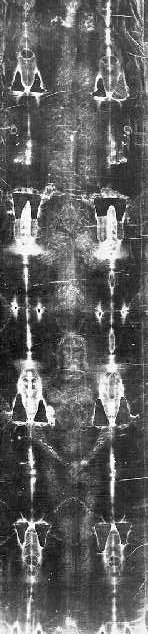
Mais recentemente, foi feita a datação do famoso “Sudário de Turim”. Um sudário é um pano para limpar o suor. Mas, no caso, o Sudário de Turim, ou Santo Sudário, é uma peça longa de tecido contendo um intrigante padrão de manchas que mostram uma figura muito assemelhada com a imagem de Jesus – ou, pelo menos, com o ícone convencional associado a Jesus.
Esse sudário apareceu na Europa no século 13 e, desde essa época, tem sido objeto de muita controvérsia. Já naquele tempo, um bispo encarregado pelo Papa de investigar a autenticidade da peça opinou que era uma fraude. Esse bispo chegou a descobrir um artista que confessou ter pintado a imagem. Assim mesmo, o sudário foi preservado e muita gente acreditava, e ainda acredita, que ele foi a mortalha de Jesus, após ser descido da cruz. No fim do século 19, com os recursos da fotografia, observou-se que um negativo da imagem era uma imagem positiva detalhada e fiel de um corpo humano, inclusive com marcas de feridas nas mãos e nos pés. Isso reforçou a crença dos fiéis, com o argumento de que um falsário não teria o cuidado de produzir uma imagem negativa.
É claro que, desde que surgiu o método do carbono-14, cogitou-se de fazer uma datação de uma amostra tirada do tecido do sudário. A Igreja relutou um bocado em conceder um pedacinho do pano para análise até que, em 1988, forneceu amostras para três laboratórios, na Alemanha, na Suiça e nos Estados Unidos. Os três testes obtiveram valores de datação muito coerentes, todos entre 1250 e 1400, exatamente a época em que o sudário surgiu na Europa.
Portanto, a datação por carbono-14 comprovou que o tecido não tem 2000 anos, como deveria ter se tivesse servido de mortalha para Jesus. Aliás, quem acredita nisso está pondo em dúvida a própria Bíblia. O Evangelho de São João diz que o corpo de Jesus foi envolvido por várias peças de tecido, sendo uma delas um lenço que lhe cobria o rosto. Além disso, os judeus costumavam lavar o corpo de seus mortos e não deveria haver manchas de sangue no tecido, se ele fosse autêntico. Na minha opinião, depois que a datação demonstrou que o pano era do século 13, não há mais razão para acreditar que esse sudário foi mortalha de Cristo. O próprio Cristo, certamente, dispensaria esse tipo de evidência duvidosa de sua passagem pela Terra.
Apostila 5: Outros métodos de datação radioativa.
O método do carbono-14 não serve para medir a idade de rochas pois se limita a tempos de, no máximo, uns 50.000 anos. Para datar rochas os isótopos mais convenientes são o urânio-238, o potássio-40 e e rubídio-87. Veja, novamente, a tabela com as meias-vidas desses isótopos, para relembrar.
| ISÓTOPO PAI | ISÓTOPO FILHO | MEIA-VIDA |
| Carbono-14 | Nitrogênio-14 | 5730 anos |
| Potássio-40 | Argônio-40 | 1,25 bilhões de anos |
| Urânio-238 | Chumbo-206 | 4,5 bilhões de anos |
| Rubídio-87 | Estrôncio-87 | 48,8 bilhões de anos |

Vamos falar sobre dois desses isótopos: o urânio-238 e o potássio-40.
O urânio-238 tem duas vantagens como datador de rochas: é abundante e tem uma meia-vida bem grande (4,5 bilhões de anos). Em uma amostra normal contendo urânio, 99,3% são de urânio-238. Já vimos que ele é radioativo e se transforma, depois de uma longa série de mutações, em chumbo-206, que é estável.
A receita para medir a idade de uma rocha que contém urânio é a seguinte:
1) dissolve-se um pedaço da rocha em ácido;
2) retira-se e separa-se o urânio e o chumbo;
3) mede-se a quantidade de cada um.
Se você lembra das apostilas anteriores, sabe como usar aquela fórmula para calcular a idade da rocha conhecendo esses dados.
Se o número contado de átomos de urânio for N1 e o número de átomos de chumbo for N2, a idade T da rocha será calculada pela expressão:
Existem uns probleminhas no uso dessa fórmula pois ela se baseia em suposições que nem sempre são corretas. Uma delas é acreditar que todo o urânio que virou chumbo ficou na amostra. Mas, se você olhar a seqüência de decaimento ali em cima verá que um dos elementos intermediários é o radônio-222. Esse radônio é um gás e, como todo gás que se preza, gosta de escapar pelo mundo afora. Se ele escapa mesmo, não vai acabar como chumbo na amostra. O resultado é que a idade medida será menor que a idade real da rocha.
Outro problema é que parte do chumbo na amostra pode não ter se originado no decaimento do urânio. Alguma quantidade de chumbo na amostra pode já ter se incorporado quando a rocha se formou. É o chamado “chumbo primário”, ou não-radiogênico (belo nome).
Por sorte, há uma forma de saber quanto do chumbo na amostra é primário. O chumbo tem outro isótopo, o chumbo-204, que não tem origem no decaimento de ninguém. Se houver chumbo-204 em uma amostra, só pode ser primário. Se a gente souber qual é a proporção natural de chumbo-204 e chumbo-206 em uma amostra não radiogênica, o problema está resolvido. Essa proporção é achada medindo as percentagens de todos os isótopos de chumbo em um meteorito.
Um meteorito, como você sabe, é uma pedra desgarrada, perdida no espaço inter-planetário. São sobras do material que formou os planetas, há bilhões de anos. Essas pedras têm tamanhos variados e, a todo instante, elas estão caindo sobre a Terra.

Se você tiver o privilégio de visitar o sertão de Sobral, longe das luzes elétricas, verá vários deles riscando o céu noturno: são as erroneamente chamadas “estrelas cadentes”, que não têm nada a ver com estrelas.
Meteoritos riscando o céu de Sobral em uma noite típica.
Por sorte, a grande maioria dessas pedras é de pequeno tamanho e se desintegra ao entrar em nossa bendita atmosfera, deixando um belo rastro luminoso. A 60 milhões de anos, porém, um dos grandes, com 10 quilômetros de comprimento, caiu na Terra e fez um estrago tão grande que acabou com a raça dos dinossauros. Um meteorito do tipo chamado “de ferro” contém chumbo mas não contém urânio. Logo, todo o chumbo nele é primário. Portanto, as proporções dos isótopos de chumbo nesses meteoritos fornece um ótimo padrão de comparação com as rochas da Terra. Neles, 2% do chumbo é chumbo-204 e 20% é chumbo-206. Isto é, para cada átomo de chumbo-204 em uma amostra, devem existir 10 átomos de chumbo-206 não-radiogênico. Se, por acaso, a rocha não contiver nenhum chumbo-204, todo o chumbo que há nela formou-se pelo decaimento do urânio-238 e sua datação deve dar um excelente resultado.
O melhor mesmo, para obter resultados confiáveis, é complementar a datacão por urânio-238 com outros métodos. Um deles, muito usado, utiliza o isótopo potássio-40. O potássio é o elemento de número 19 na tabela periódica. Um pequena fração de 0,0118% do potássio natural é formada pelo isótopo 40K19, que tem 19 prótons e 21 neutrons, é claro. Esse isótopo é radioativo e vira cálcio-40 emitindo uma partícula beta, segundo a reação:
Só que o argônio, como o radônio, é um gás. Portanto, o método só pode ser usado se o argônio, depois de formado, ficar preso na rocha. Isso costuma acontecer nas rochas que contêm o mineral chamado “mica”, que aqui no sertão o povo chama de malacacheta. Você na certa já viu a mica que é usada como isolante nos ferros elétricos de engomar.
Pois bem, usando esse método e complementando com outros, é possível obter bons resultados na datação de rochas e, por tabela, calcular a idade da Terra. É sobre isso que falarei na próxima apostila.
Apostila 6: Qual é mesmo a idade da Terra?

Lord Kelvin
Lord Kelvin, um dos maiores sábios do século 19, era um craque em termodinâmica, ciência que ele ajudou a criar. Um dia ele resolveu usar seus conhecimentos da ciência do calor para calcular a idade do planeta Terra. Supôs que a Terra, ao se formar, era uma enorme rocha incandescente e calculou quanto tempo levaria para que ela esfriasse e se solidificasse, emitindo calor para o espaço. Foi um cálculo relativamente fácil e ele obteve um valor em torno de 100.000 anos.
Isso desagradou os geólogos que estimavam a idade da Terra observando as camadas da crosta e obtinham valores bem maiores que esse. Também os biólogos, adeptos da ainda muito controvertida teoria da evolução de Charles Darwin, preferiam acreditar em um número mais dilatado, que permitisse o desenvolvimento das espécies que populam o planeta.
Kelvin, na verdade, estava quadradamente enganado. Mas, não tinha culpa pois seu cálculo estava errado por não levar em conta uma coisa que ninguém ainda conhecia naquele tempo: a radioatividade. Quando os físicos começaram a estudar e entender esse novo fenômeno, constataram que ele deveria contribuir com uma enorme quantidade de calor e esse calor não tinha sido levado em conta por Kelvin. Como esse novo ajuste, calcularam de novo a idade da Terra e concluiram que ela deveria ter pelo menos 1,5 bilhão de anos.
Os processos que descrevi na apostila anterior permitem calcular a idade das rochas, que é o tempo decorrido desde que elas se solificaram pela última vez. Portanto, depois que a Terra esfriou, transcorreu um tempo igual a, no mínimo, a idade da rocha mais velha que existe. Isto é, a idade da Terra deve ser obtida somando o tempo de esfriamento (1,5 bilhão de anos) com a idade da rocha mais velha que se encontre.
As rochas mais antigas encontradas na Terra, que são granitos da Africa do Sul, foram datadas em cerca de 3,8 bilhões de anos. Portanto, a Terra deve ter, no mímino, uns 4,3 bilhões de anos.

Um meteorito típico.
Um teste independente consiste em medir a idade dos meteoritos. Como vimos, esses meteoritos são pedras de tamanhos variados que vagam pelo espaço entre os planetas do sistema solar. A figura ao lado mostra um deles. É quase impossível, para um leigo, distinguir um meteorito como esse de uma vulgar pedra de calçamento, mas, um bom geólogo reconhece com certa facilidade. Os meteoritos se formaram ao mesmo tempo que a Terra. Mas, como são pequenos, resfriaram rapidamente. Sua idade, medida por um método usual de datação isotópica, deve ser igual a idade da Terra. Usando datações de urânio-238 e rubídio-87, os cientistas acharam tempos da ordem de 4,6 bilhões de anos. Essa deve ser, portanto, a idade da Terra.
Mais um teste bem interessante consistiu na medida da idade de pedras trazidas da Lua pelos astronautas. Ninguém ficou muito surpreso quando as datações dessas rochas indicaram valores em torno de 4,6 bilhões de anos.
Apostila 7: Uma visita a um laboratório de carbono-14.
A física nuclear, a radioatividade e os isótopos parecem atrair as mulheres que se interessam por ciência. Maria e Irene Curie, Lise Meitner, Maria Mayer, são alguns nomes de mulheres que brilharam nessa seara.

Aqui no Ceará, a física dos isótopos e da datação isotópica é praticada pela professora Marlúcia Santiago. Para ver de perto o trabalho dessa pesquisadora, me conformei a ir até Fortaleza, coisa de meu desagrado (as únicas cidades que amo são Sobral e Viena). Valeu a pena o desconforto. Fiquei conhecendo um trabalho científico de alta qualidade e relevância para nós do Nordeste brasileiro.
A seguir, no melhor estilo de reportagem dos grandes jornais, reproduzo trechos de minha entrevista com a Prof.

Marlúcia. Como não uso recursos tipo gravador, as frases estão como ficaram na minha (ainda perfeita) memória.
Fifi: Que tipo de datação isotópica vocês usam?
Marlúcia: Atualmente, usamos exclusivamente a datação por carbono-14. Antes, usávamos também o trício, mas, a quantidade desse isótopo na atmosfera do hemisfério sul está baixa demais para dar bons resultados.
F: Como é medida a atividade do carbono-14 em seu laboratório?
M: Usamos contadores proporcionais a gás e contadores de cintilação líquida. No primeiro caso, as amostras são transformadas em gás carbônico ou acetileno, usando linhas de vácuo. Na cintilação líquida, o acetileno é transformado em benzeno.
F: O que vocês estudam com essas técnicas?
M: Nosso maior interesse é estudar as reservas de água do Nordeste, como elas se distribuem, qual a idade das águas subterrâneas e como os aquíferos se interligam.
F: E como é que o carbono-14 entra nesses estudos?
M: A atmosfera tem gás carbônico e a água superficial dos rios e lagoas absorve esse gás. Na água, o gás carbônico vira bicarbonato dissolvido. Em uma amostra de água superficial, a proporção de carbono-14 é a mesma da atmosfera. Quando a água está presa em reservas subterrâneas, os átomos de carbono-14 que ela possui vão gradualmente se transformando em nitrogênio e não são repostos. Portanto, a atividade do carbono-14 em águas “velhas” vai diminuindo com o tempo e dá uma medida de quanto transcorreu desde que a água ficou confinada.
F: Legal! É praticamente o mesmo método usado para datar madeiras e tecidos orgânicos, como inventado por Libby. E quais são os resultados mais importantes que vocês obtiveram?
M: Um deles foi descobrir que houve uma forte mudança climática no Nordeste. Há cerca de 12.000 anos antes de hoje, chovia muito no Nordeste e a temperatura média era uns 6oC mais baixa do que é atualmente. Durante esse período, formou-se a segunda reserva de água subterrânea do Brasil, que é a bacia sedimentar do Maranhão-Piauí.
F: Então, já fez frio no Piauí!
M: Sim. E o que temos agora é que essa reserva subterrânea é grande porém finita. Como o armazenamento dessa água ocorreu em condições climáticas bem melhores que as atuais nessa região, as reservas não são mais abastecidas. A água nelas é toda antiga, o que chamamos de paleoágua. Se forem retiradas indiscriminadamente, vão fatalmente se esgotar.
F: E aqui no Ceará, o que vocês descobriram?
M: Bem, no Cariri as águas também são paleoáguas, logo merecem o mesmo cuidado que as águas do Piauí.
Em outras áreas do estado, vimos que as águas muito salinizadas do cristalino, que corresponde a 75% da área do Ceará, são águas recentes. Algumas pessoas pensavam que essas águas, por serem salgadas, eram provenientes de antigas intrusões marinhas. Nossa pesquisa mostra que isso não ocorreu.
F: Isto é, o mar não virou sertão.
M: É mesmo. Outro resultado interessante foi detetar uma grande perda de vazão no rio Jaguaribe. Esse rio, que era temporário, foi perenizado pelo açude Orós. Pois acontece que, em um trecho de uns 50 quilômetros, perto de Limoeiro e Russas, o rio Jaguaribe perde uma quantidade de água equivalente ao consumo de Fortaleza. Fizemos um acompanhamento dessa água através da datação isotópica e descobrimos que ela se esvai por infiltração e acaba alimentando o arenito do Açu.
F: Em outras palavras, o Rio Grande do Norte está gatunando nossa preciosa água.
M: (ri) É isso mesmo!
F: E quais os projetos futuros da equipe?
M: Pretendemos identificar as condições das águas armazenadas na formação Mauriti, no sul do estado, onde está sendo implantado um projeto de agricultura irrigada utilizando essas águas.
F: Vocês não pretendem usar o carbono-14 para o uso tradicional de datar tecido orgânico?
M: Sim, estamos desenvolvendo uma metodologia para datação de ossos. Nesse tipo de determinação de idade é necessário retirar o colágeno da amostra e transformá-la em acetileno que será usado no detetor.
Fiquei muito feliz de ver a qualidade e importância da pesquisa feita por essa conterrânea e sua equipe. Meu neto Felipe sugeriu que eu mandasse uma amostra da água de nosso poço para saber se é mais nova ou mais velha que eu.
Nota do editor: Mais informações sobre o grupo de carbono-14 do Departamento de Física da UFC podem ser obtidas através do e-mail: marlucia@fisica.ufc.br
Apostila 8: Quando foi que a mulher chegou ao Piauí?

Niède Guidon
Acho graça quando leio nos jornais ou revistas que o homem chegou às Américas há tantos mil anos atrás. Se apenas homens tivessem chegado, em pouco tempo não sobraria ninguém. Mais importante é saber quando chegaram as mulheres!
Pois bem, no sertão brabo do Piauí trabalha uma arqueóloga brasileira, a prof. Niède Guidon, que garante que as mulheres chegaram ao Brasil há uns 50.000 anos.
Em São Raimundo Nonato, na Boqueira da Pedra Furada, Niède achou restos de fogueiras com toda a pinta de terem sido acesas por mãos humanas. Ao que parece, a datação do material dessas fogueiras indica essas datas tão remotas. No local, que fica na Serra da Capivara, Niède criou e dirige o Museu do Homem Americano, nome que, evidentemente, não é do meu agrado.
Os arqueólogos americanos não gostam dessa história. Preferem acreditar que os humanos (homens e mulheres, é claro) entraram na América pelo extremo norte, através do estreito de Behring, há 12 mil anos e só teriam chegado à América do Sul há, no máximo, uns 10 mil anos. Eles acham que as fogueiras de São Raimundo Nonato tiveram origem não humana.
Entretanto, mais recentemente foram achadas outras evidências indicando que os americanos estão errados. No Chile, há indícios bem claros da presença humana há, pelo menos, 13 mil anos. E, para liquidar de vez a arrogância desses ianques, a equipe de outra arqueóloga brasileira, a prof. Águeda Vialou, encontrou artefatos feitos por mãos humanas em uma área no Matogrosso, a 120 quilômetros de Cuiabá. Essas peças são ossos animais cortados, polidos e furados, na forma de contas de colar. A datação por urânio das camadas de solo onde as peças foram encontradas deram valores em torno de 27 mil anos. Talvez os americanos venham dizer que essas peças foram polidas por macacos ou pelo vento.

