A Descoberta do Oxigênio
As glórias e atribulações dos descobridores desse gás indispensável.
O OXIGÊNIO é o terceiro elemento mais abundante no Universo, só perdendo para o Hidrogênio e o Hélio. Ele é um gás que representa cerca de 21% da atmosfera do planeta Terra – o restante é quase só Nitrogênio. Além disso, é responsável por quase metade da massa da crosta terrestre. Os animais, nós inclusive, precisam dele para respirar e viver. Na verdade, 2/3 da massa de nossos corpos é de Oxigênio. O que não é de admirar, pois esse elemento contribui com 9/10 da massa da água.
A história da descoberta do Oxigênio é tão interessante quanto a importância do próprio elemento. Como veremos a seguir, contém lances de grande valor científico paralelamente a outros, de natureza política e acadêmica.
De quebra, aprenderemos como um conceito usado no passado teve de ser descartado com a descoberta do Oxigênio. E como o mecanismo da respiração animal foi explicado e associado a processos de combustão.
Vamos lá.
As observações de Scheele e Priestley.
Quem primeiro conseguiu separar e isolar uma amostra do gás que hoje chamamos de OXIGÊNIO foi o apotecário (farmacêutico) sueco Carl Wilhelm Scheele. Seu experimento, realizado em 1773, consistiu em aquecer uma amostra do “mercúrio calcinado”, um pó avermelhado hoje conhecido como Óxido de Mercúrio (HgO). Fazendo isso com o pó encerrado em uma campânula fechada, ele observou que o ar dentro da campânula mudava suas características normais. Uma dessas mudanças mais evidentes era que, na presença desse ar modificado, a chama de uma vela ficava bem mais intensa que o normal. Por essa razão, Scheele chamou esse gás de “ar de fogo”. Hoje, sabemos que esse “ar de fogo” é simplesmente o Oxigênio. Scheele não sabia, mas o aquecimento do Óxido de Mercúrio estava liberando um dos componentes do pó, o gás Oxigênio.
Infelizmente, Scheele não conseguiu publicar imediatamente seus resultados e esse trabalho ficou esquecido por muito anos. Para complicar um pouco a coisa toda, Scheele, que trabalhava isolado em sua farmácia na Suécia, enviou uma carta relatando essas observações ao famoso químico francês Lavoisier. Como veremos depois, essa carta deu o que falar.
Um ano depois, na Inglaterra, o pastor protestante e químico Joseph Priestley, sem conhecer o trabalho de Scheele, fez o mesmo tipo de experimento e obteve, é claro, resultados idênticos. A experiência e sua observação foram impecáveis, o problema surgiu na interpretação que Priestley, como Scheele anteriormente, deu para o que estava acontecendo dentro da campânula. Ambos acreditavam, como aliás praticamente todo mundo, na chamada Teoria do Flogístico, proposta alguns anos antes pelo alemão George Stahl.
Segundo essa crença, todo material capaz de ser queimado ou derretido (madeira, óleo, ferro etc) conteria uma espécie de fluido sem peso, o “flogístico”. Queimar ou derreter o material equivaleria a deixar escapar o flogístico de dentro dele para o ar exterior. Com isso, restaria apenas cinza ou metal derretido. O ar atmosférico também conteria bastante flogístico mas não seria completamente “flogistado” pois sempre poderia receber mais flogístico.
Já era sabido que a chama de uma vela encerrada em uma campânula rapidamente se extinguia. A explicação geral era que a queima da vela enchia o ar da campânula de flogístico até saturá-lo. Quando o ar não agüentava mais receber flogístico, a vela apagava. O experimento básico de Scheele e Priestley consistiu em aquecer o pó avermelhado chamado de “mercúrio calcinado” dentro de uma campânula de vidro totalmente vedada onde ficava uma vela acesa. Para conseguir queimar o pó encerrado na campânula era necessário aquecê-lo com o uso de uma lente externa focalizando a luz do Sol, artifício muito engenhoso.
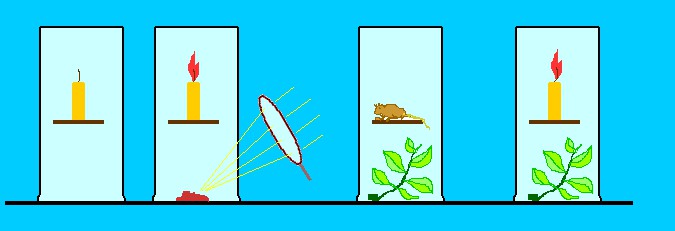
O resultado surpreendente desse experimento foi que, enquanto o mercúrio calcinado era aquecido a vela não apagava; pelo contrário, sua chama ficava até bem mais brilhante. De alguma forma, o pó aquecido favorecia e sustentava a combustão.
A explicação de Priestley para esse resultado foi baseada na hipótese do flogístico. Segundo ele, o pó quente reagia com o ar da campânula e dele retiraria o flogístico, pelo menos parcialmente. Isto é, o ar na campânula ficaria “deflogistado” pois perderia seu flogístico para o pó aquecido. Com isso, a vela não apagava já que o flogístico que ela exalava era consumido pelo pó e não haveria saturação do ar.
Priestley ainda fez outras experiências bem interessantes com seu “ar deflogistado”. Como já era sabido, um rato preso em uma campânula totalmente vedada morria depois de algum tempo. A explicação dada para esse infeliz acontecimento era simples: a respiração do rato também produz flogístico, de modo semelhante, embora mais lento, à queima da vela. Mas, se além do ratinho, a campânula contivesse um pouco de mercúrio calcinado aquecido, o rato sobrevivia. Era mais uma comprovação de que o pó aquecido chupava flogístico.
E teve mais. Em outro teste, Priestley colocou a vela queimando (ou um ratinho) juntamente com uma planta verde dentro da campânula. E o resultado foi ainda mais curioso: a vela levava muito tempo para apagar e o rato muito tempo para morrer. A conclusão natural foi que as plantas também absorvem o flogístico, como o pó quente de mercúrio calcinado, só que de modo mais lento. Isto é, as plantas contribuem para manter o ar deflogistado, portanto, respirável. Se elas não existissem para deflogistar o ar que respiramos, todos nós morreríamos sufocados.
Como vemos, as observações de Scheele e Priestley foram muito precisas e suas explicações bastante convincentes. Só que essas explicações estavam erradas, como veremos a seguir.
As experiências e conclusões de Lavoisier.
O francês Antoine Lavoisier é considerado, com justiça, o iniciador da Química moderna. Em 1789, ano em que teve início a Revolução Francesa, ele revolucionou a Química com a publicação de seu livro “Tratado Elementar de Química”.
Entre os incontáveis feitos científicos de lavoisier o que nos interessa nesse relato trata de sua reprodução ampliada dos experimentos de Scheele e Priestley e sua interpretação dos resultados, que foi diversa daquela dada pelos antecessores.
Lavoisier era um mestre na medida precisa das massas envolvidas em reações químicas. Todo experimento que fazia incluia uma pesagem cuidadosa e precisa dos constituintes, antes e depois das reações, mesmo quando os reagentes se modificassem por completo na forma e aparência. Quando refez os experimentos de Priestley, o francês, como era seu costume, fez medidas quantitativas em todo o processo. A figura abaixo representa, esquematicamente, o experimento inicial de Lavoisier sobre o gás obtido por Priestley e Scheele.
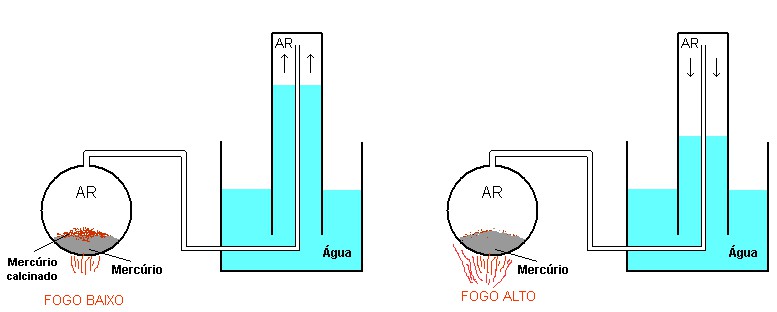
No globo da esquerda ficava encerrada uma certa quantidade de mercúrio metálico, esse líquido brilhante e pesado que todos conhecemos. O ar do globo era conectado por um tubo à parte superior de um frasco invertido mergulhado em água. Antes de iniciar sua experiência, Lavoisier media com precisão a quantidade de mercúrio e o volume de ar no frasco invertido. Aquecendo levemente o mercúrio no globo, observou que o pó avermelhado (o mesmo “mercúrio calcinado” usado por Priestley) se formava sobre o metal. Ao mesmo tempo em que o pó era formado, o nível da água no frasco SUBIA, isto é, o volume de ar DIMINUIA. Ele concluiu que uma parte do ar estava passando para o mercúrio e se combinando com ele para produzir o mercúrio calcinado. Medindo esse volume, ele concluiu, como Priestley fizera antes, que a quantidade de ar retirada no processo era cerca de 1/5 do ar total.
Além disso, Lavoisier viu que o processo todo podia ser invertido quando se aumentava bastante o calor da chama sob o globo. Quando isso era feito, o pó avermelhado sumia, o mercúrio metálico era restaurado e o volume do ar no frasco voltava ao valor inicial.
A explicação dada por Lavoisier para esse resultado não utilizava o flogístico, entidade na qual ele não acreditava. Segundo ele, um quinto (1/5) do ar contido no frasco seria um tipo de gás que pode se combinar com o mercúrio para formar o mercúrio calcinado em um processo reversível. A esse gás ele deu o nome de OXIGÊNIO, que pode ser traduzido capengamente por “gerador de óxidos”.
Modernamente, esses processos são descritos pelas reações:
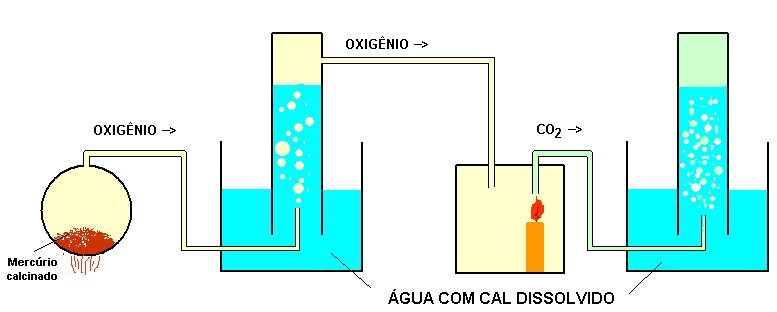
Essas experiências convenceram Lavoisier – e o resto do mundo – de que o gás produzido pelo aquecimento do mercúrio calcinado é o mesmo gás produzido pelas plantas, um gás respirável que chamou de “oxigênio”, e que constitui 1/5 do ar atmosférico. Já o gás produzido pela queima da vela ou pela respiração dos animais é outro gás, hoje chamado de gás carbônico (CO2). Na figura acima, os termos modernos são usados para simplificar o entendimento do processo. Com esses resultados, Lavoisier sepultou de vez o tal “flogístico”, que ficou desnecessário para a explicação de qualquer fenômeno químico.
Esses resultados foram apresentados por Lavoisier à Academia Francesa de Ciência em 1791, em pleno período revolucionário. Menos de três anos depois, ele foi guilhotinado pelo governo revolucionário.
Um experimento e duas explicações.
Scheele, Priestley e Lavoisier, nessa ordem, fizeram a mesma experiência com uma vela ou um ratinho em uma campânula. Os dois primeiros explicavam porque a vela apaga do seguinte modo:
– O ar na campânula, inicialmente, é igual ao ar atmosférico normal. 80% dele estão contaminados pelo flogístico e o restante é ar deflogistado. A queima da vela (ou a respiração do ratinho) joga mais flogístico no ar e isso continua até que todo o ar dentro da campânula seja contaminado. Quando isso acontece, a vela apaga ou o ratinho morre por falta de ar deflogistado, próprio para respiração ou combustão. O aquecimento do mercúrio calcinado produz ar deflogistado ao retirar o flogístico do ar encerrado na campânula. O mesmo acontece, mais lentamente, se uma planta estiver dentro da campânula.
A explicação de Lavoisier não apelava para o flogístico:
– O ar atmosférico não é um gás único mas uma mistura de dois ou mais gases. 20% do ar normal é formado de um gás que sustenta a chama da vela (ou pode ser respirado pelo ratinho). A combustão (ou a respiração) consome o gás respirável formando um gás diferente que vai gradualmente enchendo a campânula. Quando todo o gás respirável é consumido e transformado no outro gás, a vela apaga ou o ratinho morre. O aquecimento do mercúrio calcinado ou a presença de uma planta na campânula produzem o gás respirável mantendo a vela acesa ou o ratinho vivo. Esse gás respirável, que equivale a 20% do ar normal, é o Oxigênio.
Por causa dessa discordância, e levando em conta a importância histórica e científica da descoberta do Oxigênio, muita saliva já foi gasta na discussão de quem merece o título de “descobridor” desse elemento.
Seria Scheele, já que foi o primeiro a fazer as experiências?
Ou seria Priestley que, sem conhecer o trabalho de Scheele, fez as mesmas experiências e publicou seu trabalho antes de todos?
Ou, finalmente, seria Lavoisier, já que foi quem fez os experimentos e deu a explicação correta para seus resultados?
Essas dúvidas são divertidas mas não acrescentam nada. É o mesmo que dizer que Cabral “descobriu” o Brasil, quando esse território já era habitado por gente há milhares de anos. Como contaremos na seção seguinte, os três “descobridores” do Oxigênio foram grandes homens da ciência e merecem as homenagens por seus trabalhos. O resto é filigrana.
As atribulações dos descobridores do Oxigênio.

Carl Wilhelm Scheele
Os pormenores das vidas dos descobridores do Oxigênio já foram assunto para muitos artigos e livros e até peças teatrais. O pessoal gosta de lembrar que Priestley, o teimoso que até morrer acreditou na teoria furada do flogístico, tinha posições políticas avançadas, defendeu a revolução francesa e, por suas posições, foi obrigado a deixar seu país, a Inglaterra, para se refugiar na América, onde viveu o resto de seus dias.
Scheele, coitado, nunca foi rico e fez todo seu trabalho longe dos grandes centros científicos da Europa. Quando tentou contacto com um guru da Química, o grande Lavoisier, se deu mal. Descreveu suas experiências em uma carta esperando o aval e o elogio do grande homem mas nunca recebeu uma resposta e seu nome nem foi mencionado nos artigos do francês. Há quem diga que a carta foi interceptada e escondida por Madame Lavoisier, para não criar melindres e escrúpulos no marido que trabalhava no mesmo tema que Scheele. Tudo especulação, é claro.

Joseph Priestley
Quanto ao próprio Lavoisier, cujas opiniões de vanguarda científica geraram uma nova Química, era um reacionário que trabalhava para a nobreza corrupta que detinha o poder na França. Naquele tempo os impostos eram um verdadeiro roubo (como ainda são aqui) e só a ralé era obrigada a pagá-los. Os aristocratas eram isentos. E a tarefa de cobrar os impostos era terceirizada, já que gente fina não se mistura com essas questões mesquinhas de dinheiro – só usufruem dele. Lavoisier, que não era nobre, era um desses encarregados de cobrar impostos. E, competente como sempre, era uma fera nesse serviço. Não deu outra: quando a revolução tomou o poder, o grande sábio foi preso e guilhotinado.
De qualquer forma, os três foram grandes cientistas. Scheele descobriu um número impressionante de elementos e compostos químicos, entre eles o oxigênio, o nitrogênio, o bário, o cloro, o glicerol e o cianeto de hidrogênio. Além disso, inventou um método eficiente de produzir o fósforo, fazendo da Suécia um dos maiores produtores desse elemento até hoje.

Antoine Lavoisier e esposa, pintados por David
Priestley, que também descobriu o oxigênio, isolou o gás carbônico e dissolveu esse gás na água, inventando assim a “água soda”, base de todo refrigerante moderno.
Quanto a Lavoisier, que também descobriu o oxigênio, nada precisa ser acrescentado além da constatação de que ele inaugurou a Química moderna. Inventou uma nomenclatura decente para os compostos, enunciou a Lei da Conservação das Massas e escreveu um livro clássico que ainda hoje pode ser usado como livro texto.
REFERÊNCIAS:
A respiração e a 1a Lei da Termodinâmica – Leopoldo De Meis e Diucênio Rangel.
Oxigênio – peça teatral de Carl Djerassi e Roald Hoffmann.
Great Scientific Experiments – Rom Harré.

