Energia Elétrica de Origem Química
Objetivo
Mostrar como se converte energia do calor em energia elétrica. Construir um termômetro termo-elétrico.
Descrição
Em 1821, o físico alemão Thomas Seebeck descobriu que, juntando as pontas de dois fios de metais diferentes (ferro e cobre, por exemplo), e mantendo as junções em temperaturas diferentes, surgia uma corrente elétrica pelos fios.
Vamos reproduzir essa experiência.
Experiência 1.
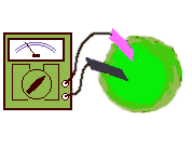 Use fios de cobre e ferro, sem encapamento. Enrole fortemente as pontas, formando junções cobre/ferro. Pode-se melhorar o contato entre os metais com um pingo de solda na junção.
Use fios de cobre e ferro, sem encapamento. Enrole fortemente as pontas, formando junções cobre/ferro. Pode-se melhorar o contato entre os metais com um pingo de solda na junção.
Experiência 2.
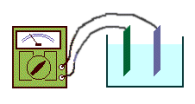 Agora vamos construir uma bateria simples. Usaremos uma solução diluída de ácido sulfúrico. (CUIDADO! Use luvas e óculos de proteção!)
Agora vamos construir uma bateria simples. Usaremos uma solução diluída de ácido sulfúrico. (CUIDADO! Use luvas e óculos de proteção!)
Ponha a solução em um recipiente de vidro e mergulhe nela um par de placas de metais diferentes – cobre e zinco, por exemplo. Usando contatos tipo “jacaré”, ligue as placas a um medidor de corrente (galvanômetro), que pode ser o mesmo que você fez na experiência anterior. Anote o valor medido. Faça outras medidas com pares diferentes de metais.
Experiência 3.
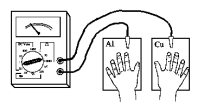 Você vai construir um detetor de mentiras de mentira. Arranje duas placas de metais diferentes (cobre, zinco, alumínio etc). Faça um bom polimento nessas placas usando lixa fina, bombril e sapólio. Coloque-as sobre uma mesa de madeira e ligue-as, com pontas tipo jacaré, ao seu medidor elétrico. Ponha suas mãos sobre as placas e observe se o ponteiro do medidor acusa alguma mudança. Umedeça um pouco suas mãos e repita a experiência. Você pode umedecer as mãos suando ao fazer alguns exercícios, como flexões, apoio de frente etc. Em princípio, com as mão suadas o galvanômetro deve indicar uma corrente maior.
Você vai construir um detetor de mentiras de mentira. Arranje duas placas de metais diferentes (cobre, zinco, alumínio etc). Faça um bom polimento nessas placas usando lixa fina, bombril e sapólio. Coloque-as sobre uma mesa de madeira e ligue-as, com pontas tipo jacaré, ao seu medidor elétrico. Ponha suas mãos sobre as placas e observe se o ponteiro do medidor acusa alguma mudança. Umedeça um pouco suas mãos e repita a experiência. Você pode umedecer as mãos suando ao fazer alguns exercícios, como flexões, apoio de frente etc. Em princípio, com as mão suadas o galvanômetro deve indicar uma corrente maior.
Análise
Em todas essas experiências, há conversão de energia química em energia elétrica. Cada metal tem uma certa capacidade de trocar elétrons – uns mais, outros menos. Quando postos em contato com algum material que possa fornecer ou receber elétrons, um metal pode ficar carregado negativamente, em relação ao outro. Por exemplo, na bateria ocorrem reações químicas entre as placas de cobre e zinco e a solução de ácido sulfúrico. Como resultado dessas reações, a placa de cobre perde alguns elétrons e fica positiva, enquanto a placa de zinco ganha alguns elétrons e fica negativa. Entre elas, surge, dessa forma, uma diferença de potencial elétrico da ordem de 1 Volt. Seu medidor pode acusar essa voltagem. Se você tiver uma pequena lâmpada usada nos faroletes dos carros, ela pode ser acesa com essa bateria rudimentar.
O detetor de mentiras se baseia na suposição de que um mentiroso, ao mentir, fica com as mãos suadas. Hoje em dia esse tipo de teste está em desuso pois já se constatou que um mentiroso descarado não fica suado coisa nenhuma, mas, um inocente nervoso pode suar.
Material
Placas de metais diversos.
Limão, laranja ou outra fruta cítrica.
Um galvanômetro que pode ser o que você construiu na experiência 3.
Solução diluída de ácido sulfúrico, usada em baterias de carro e vendida nos postos de gasolina. CUIDADO COM ELA!
Fios diversos.
Um colega mentiroso pra ver se o detetor funciona.
Dicas
Mais uma vez: cuidado com a solução de ácido. Use luvas, máscara e óculos de proteção. Todo esse cuidado pega bem com a comissão julgadora. Não deixe o recipiente com a solução dando bobeira para evitar que algum descuidado se queime.
Leve diversos tipos de pilhas e baterias para mostrar como são por dentro. Cuidado: esses dispositivos contêm produtos químicos perigosos. Fique atento ao manuseá-los para evitar acidentes. Não é nenhum perigo apavorante mas faz parte da prática de um bom cientista, amador ou profissional, tomar as medidas básicas de segurança.

