O Efeito Raman
Um tipo de espalhamento da luz que traz informações sobre os modos que as moléculas têm de vibrar.
Nessa seção especial vamos descrever, de forma simplificada, o chamado “Espalhamento Raman”, efeito descoberto pelo físico indiano Chandrasekhar Raman e descrito no artigo que ele publicou na revista Nature, em 1928, com co-autoria de K. S. Krishnan. Por esse trabalho, Raman recebeu o prêmio Nobel de Física em 1930.
O “espalhamento” de que falamos acontece quando fótons (partículas de luz) se chocam com moléculas de uma amostra que pode ser de gás, líquido ou sólido. De modo simplificado, podemos supor que a molécula é um conjunto de átomos ligados uns aos outros por forças de origem elétrica. Essas ligações podem ser simbolizadas por pequenas “molas” entre os pares de átomos. Um fóton que atinge uma molécula pode ser “espalhado”, isto é, ter sua direção modificada, como uma bola de sinuca.
Podemos considerar dois tipos de espalhamento. Se a molécula, no choque, se comporta como uma esfera rígida, sem movimentos internos, o fóton espalhado conserva praticamente toda a energia inicial que tinha antes do choque. Esse tipo de espalhamento é chamada de “espalhamento elástico” e é o mais comum quando fótons incidem sobre moléculas.
No entanto, a molécula não uma esfera rígida. Alguns fótons, ao se chocarem com uma molécula, podem dar início a algum movimento dos átomos da molécula. Em termos mais técnicos, o fóton “excita” a molécula, cedendo a ela parte de sua energia inicial. A energia do fóton, depois do espalhamento, é menor que a inicial pois parte dela foi usada para chacoalhar a molécula. Esse é um “espalhamento inelástico”, com troca de energia entre o fóton e a molécula. O espalhamento Raman, que descreveremos nos capítulos seguintes, é um tipo de espalhamento inelástico.
Vamos, então, começar nosso relato descrevendo como podem ser as vibrações moleculares e, depois, como elas afetam os fótons incidentes sobre as moléculas.
A vibração das moléculas.
Quando falamos de vibração de uma molécula estamos nos referindo a movimentos dos átomos que deixam fixo o centro de massa da molécula. Se o centro de massa se deslocar, o movimento é de translação. Existe, também, um tipo de movimento no qual a molécula gira como um todo, rigidamente, em torno de um eixo que passa por seu centro de massa, mantendo fixas as distâncias entre os átomos. Esse é o movimento de rotação.
Existem 3 possibilidades distintas de translação, uma para cada direção no espaço tri-dimensional, e 3 de rotação, cada uma em torno de um dos três eixos que se cruzam no centro de massa da molécula. E quantas vibrações são possíveis? É fácil calcular: multiplique o número de átomos da molécula por 3, obtendo assim o número de graus de liberdade da molécula. Desse número subtraia 6, que são os 3 movimentos de translação e os 3 de rotação. O que resulta é o número de vibrações possíveis. Por exemplo, a molécula de água tem 3 átomos. Logo, tem 3×3 = 9 graus de liberdade. Então, tem 9 – 6 = 3 maneiras distintas de vibrar.
São três os modos possíveis de vibração de uma molécula de água. O primeiro é chamado de modo de esticamento simétrico, o segundo de modo de esticamento assimétrico e o terceiro de modo de dobramento. A razão para esses nomes é evidente. Com um pouco de imaginação, você pode ver que o centro de massa da molécula, que deve estar um pouco abaixo do átomo de oxigênio, fica fixo enquanto os átomos se deslocam. Os deslocamentos dos átomos são muito pequenos se comparados com as distâncias inter-atômicas. Além disso, as frequências dos movimentos reais são enormes.
Se uma molécula qualquer for excitada de algum modo apropriado, seus átomos podem adquirir movimentos que são aparentemente desorganizados, mas, uma análise cuidadosa mostrará que esses movimentos são apenas combinações dos modos normais de vibração. Como cada modo normal de vibração tem uma energia própria, conhecendo quais são esses modos e quais são suas energias saberemos muito sobre como a molécula pode interagir com os agentes excitadores. Um deles pode ser a luz que incide sobre a molécula. Suponha que um feixe de luz (fótons) incide sobre uma molécula que está paradinha em seu canto (uma ficção). É possível que a energia do fóton seja absorvida pela molécula, fazendo-a vibrar com um de seus modos normais. Nesse caso, o fóton é absorvido e sua energia vira energia de vibração. As moléculas costumam absorver fótons de luz infravermelha pois seus átomos gostam de vibrar com frequências nessa região do espectro. Esse tipo de fenômeno, chamado de absorção no infravermelho, é muito útil na caracterização das moléculas mas não é dele que queremos tratar, por enquanto. O que nos interessa agora é saber o que acontece (ou pode acontecer) quando luz de energia mais alta, na faixa da luz visível, incide sobre uma molécula.
Como vimos na introdução, um fóton de luz incidindo sobre uma molécula é espalhado por ela. Se não houver troca de energia, isto é, se a molécula espalhadora não se abalar, o espalhamento é elástico. A grande maioria dos fótons incidentes é espalhada elasticamente. Esse tipo de espalhamento é chamado de espalhamento Rayleigh, pois foi Lord Rayleigh que estudou esse processo e mostrou que é responsável pela cor azul do céu.
Alguns fótons, porém, podem excitar um modo de vibração da molécula (ou vários modos), perdendo energia no processo. Depois desse espalhamento inelástico, a molécula passa a vibrar e o fóton muda de cor, pois sua energia diminuiu. Um fóton que era de luz verde antes do choque, fica vermelho depois dele. Isso é um exagero, pois a energia perdida é pequena, se comparada com a energia inicial do fóton. A mudança de cor no processo, que na verdade é apenas uma mudança no comprimento de onda da luz, seria imperceptível ao olho.
Esse é o espalhamento Raman (ou efeito Raman), observado e explicado por Chandrasekhar Raman. Nem todo modo de vibração de uma molécula pode produzir espalhamento Raman. Os que podem são chamados de modos ativos para esse tipo de espalhamento. Alguns modos não podem ser excitados por esse tipo de espalhamento e são ditos inativos. No capítulo seguinte veremos como distinguir esses dois tipos de modos.
Como a luz interage com as vibrações moleculares.
Vamos usar o método usual de representar esquematicamente as energias dos estados de vibração com um diagrama de níveis. Cada energia possível para a vibração de uma molécula será representada por um tracinho ________, ordenados segundo valores crescentes da energia, como vimos no caso do elétron no átomo de Bohr.

Para simplificar nossa descrição, suporemos que cada modo normal de vibração só tem dois estados (e níveis de energia) possíveis. O mais baixo corresponde simplesmente à uma molécula parada, sem vibrar, logo, com energia E0 = 0. Esse é o chamado estado fundamental da vibração molecular. O outro nível corresponde à energia E1 que a molécula tem quando está vibrando em um de seus modos normais. Portanto, para convencer uma molécula que está parada a vibrar com esse modos normal você precisa presenteá-la com uma energia E1. Isso significa “excitar” a molécula, daí esse estado ser chamado de estado excitado.

Um fóton incidindo sobre a molécula pode fazer esse trabalho por você. Basta que ele tenha energia Ef igual à diferença de energia entre os níveis excitado e fundamental. Isto é, Ef = E1.
Nesse caso, o fóton pode ser engolido pela molécula e sumir. Dizemos que o fóton foi absorvido. As vibrações moleculares costumam absorver fótons que pertencem à região do infra-vermelho no espectro.
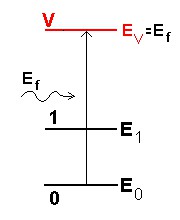
Agora, vejamos o que acontece no espalhamento Raman. Nesse caso, o fóton incidente tem uma energia Ef muito maior que a energia E1 do modo normal. Ao incidir sobre a molécula, o fóton pode excitá-la a um estado cuja energia EV é muito maior que a energia E1 do modo de vibração. Em geral, essa excitação é eletrônica, do tipo daquelas que encontramos no caso do átomo de Bohr. Mas, esses estados excitados são muito instáveis e a molécula rapidamente cai para estados de menor energia. A molécula pode, por exemplo, voltar ao estado fundamental (0), re-emitindo um fóton com a mesma energia do fóton incidente., em uma direção que pode ser diferente da direção que tinha antes. Para todos os efeitos, o fóton incidente foi simplesmente espalhado, sem perder nada de sua energia inicial. É o espalhamento Rayleigh, como já vimos. A grande maioria dos fótons que incidem sobre a molécula é espalhada desse jeito.
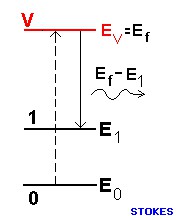
Entretanto, em alguns casos, a molécula não retorna ao estado fundamental. Depois de decair, ela fica no estado vibracional (1), com energia E1. Nesse caso, o fóton que é re-emitido em uma direção qualquer, terá sua energia diminuída para Ef – E1. A molécula e sua vibração roubaram um pouco da energia do fóton. Esse é um tipo de espalhamento Raman.
Mas, existe outra possibilidade. A molécula pode já estar vibrando com energia E1, quando o fóton incide sobre ela, levando-a a uma energia bem mais alta EV´. Desse estado V´ a molécula decai, só que agora para o estado fundamental (0). No processo, um fóton de energia Ef + E1 é emitido. Agora, foi o fóton que roubou um pouco de energia da molécula. Portanto, o processo Raman pode produzir fóton com energia maior ou menor que a energia do fóton incidente.

Quando a energia do fóton diminui, gerando uma vibração da molécula, o processo é chamado de Stokes, por razões históricas. No outro caso, em que a energia do fóton aumenta, roubando energia de vibração da molécula, o processo é chamado de anti-Stokes.
Quem faz as moléculas vibrarem, mesmo antes de receberem luz, é a agitação térmica. O ambiente onde está a amostra troca calor (energia) com as moléculas, excitando algumas delas a seus modos normais de vibração. São essas que podem produzir o espalhamento Raman anti-Stokes. Normalmente, em uma amostra a temperatura ambiente, o número de moléculas que estão no estado fundamental é muito maior que o de moléculas já excitadas termicamente. Portanto, o número de processos do tipo Stokes é maior que o número de processos anti-Stokes.
A seguir, vamos ver que tipo de vibração pode gerar um espalhamento Raman e que tipo não pode. Isso nos levará às intimidades da interação entre luz e matéria.
O espalhamento Raman e a absorção do infravermelho.

Vamos começar mostrando como uma molécula pode absorver luz infravermelha. Tomemos, como exemplo, uma molécula simples de ácido clorídrico, HCl. Na figura, a bolinha maior é o átomo de cloro e a menor, o átomo de hidrogênio. Inicialmente, a molécula está parada, sem vibração. Luz infravermelha com 3 frequências diferentes, portanto, com 3 energias diferentes, incide sobre ela. Se uma dessas 3 frequências coincidir com a freqüência de um modo normal de vibração da molécula de HCL, essa componente da luz será absorvida, transferindo sua energia para a molécula que passa a vibrar. As outras componentes passam incólumes.
Entretanto, não basta que a freqüência da luz coincida coma a freqüência da vibração para que o fóton seja absorvido. Para haver absorção, além dessa coincidência de freqüências (ou energias), é necessário que a luz gere um momento de dipolo elétrico na molécula. Ou, se a molécula já tem um momento de dipolo, a vibração precisa fazer esse momento de dipolo variar.

Um momento de dipolo elétrico, como você sabe, é simplesmente um sistema com duas cargas iguais em valor, uma positiva e a outra, negativa, separadas por uma pequena distância. No caso da molécula de HCl, uma carga negativa se acumula mais perto do átomo de cloro e uma carga negativa perto do átomo de hidrogênio.
Essa molécula tem dipolo elétrico p, medido pelo produto de uma das cargas, Q, pela distância entre elas,d. O momento de dipolo é representado por uma seta da carga negativa para a positiva, um “vetor”.
O campo elétrico da luz incidente pode interagir com as cargas e deslocá-las, como mostra a animação. Com isso, o momento de dipolo varia em sintonia com a onda de luz. É essa interação entre o campo elétrico da luz e a vibração da molécula que patrocina a troca de energia com a abosrção do fóton.
Em outras palavras: para haver absorção da luz incidente, a vibração deve variar o momento de dipolo da molécula. Note que a freqüência de vibração do dipolo coincide com a freqüência da luz incidente.
Agora, vejamos o caso do espalhamento Raman, que é um pouco mais sutil. Como vimos antes, o momneto de dipolo da molécula pode ser gerado ou modificado pelo campo elétrico da luz. Quanto maior o campo, maior o momento de dipolo, segundo a expressão: p = a E. Esse a é chamado de polarizabilidade e mede a disposição da molécula a ter momento de dipolo. Como veremos a seguir, para haver efeito Raman a polarizabilidade deve variar.
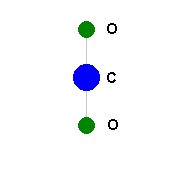
Para ilustrar, vamos considerar uma molécula de gás carbônico, CO2, que não tem momento de dipolo pois as cargas negativas e positivas, apesar de separadas, têm o mesmo centro. Um modo de vibração do tipo estiramento simétrico não afetaria esse estado de coisas, portanto não geraria dipolo. Portanto, esse tipo de vibração não absorve a luz.
No entanto, o campo elétrico da luz incidente pode induzir um momento de dipolo pois as cargas negativas da molécula (elétrons) são deslocadas de sua posição de equilíbrio. Veja, na animação abaixo, um momento de dipolo induzido que varia com a freqüência da vibração enquanto interage com um campo elétrico de freqüência mais alta. O dipolo oscilante afeta a amplitude da onda de luz fazendo com que essa amplitude flutue com a freqüência da vibração. Diz-se que a onda foi “modulada” pela variação do dipolo. Parte da energia da luz é perdida na interação. Esse é o caso Stokes. O caso anti-Stokes ocorreria se a amplitude fosse aumentada pela vibração já existente do dipolo da molécula.
A seguir, vamos mostrar como é o jeitão de um espectro Raman e como tirar dele informações sobre a molécula examinada.
Um exemplo de espectro Raman.
No laboratório, um espectro Raman é obtido fazendo-se a luz monocromática de um laser incidir sobre a amostra que se quer estudar. A luz esplhada é dispersada por uma rede de difração no espectrômetro e suas componentes são recolhidas em um detetor que converte a intensidade da luz em sinais elétricos que são interpretados em um computador na forma de um espectro Raman. A figura abaixo mostra um dos equipamentos de espalhamento Raman usados no Laboratório do Departamento de Física da UFC. Para contrastar, a outra fotografia mostra o equipamento usado pelo próprio Raman, na década de 20. A fonte de luz que ele usou foi o velho Sol.


Vamos ilustrar o resultado de uma experiência Raman observando o espectro obtido com uma amostra de tetracloreto de carbono (CCl4). A molécula de CCl4 tem a forma de um tetraedro com o átomo de carbono no centro e os átomos de cloro nos vértices. Como essa molécula tem 5 átomos, o número de modos normais de vibração, como já vimos, deve ser 5×3 – 6 = 9. A figura mostra 4 desses modos e as linhas Raman associadas a eles. A energia indicada em inverso de centímetros para cada linha corresponde à energia “roubada” da luz do laser pela vibração. Essa figura mostra apenas o espectro Raman Stokes.
Na verdade, essas 4 linhas correspondem a todos os 9 modos de vibração do CCl4. Três delas estão associadas a vários modos com energias iguais. São modos ditos “degenerados”. Por exemplo, a linha de 770 cm-1, correspondente ao modo chamado de “estiramento assimétrico”, representa o conjunto de 3 modos de vibração que só diferem pela orientação espacial dos movimentos dos átomos. Logo, devem ter a mesma energia.

NOTA: O inverso de centímetro (cm-1) é uma unidade de energia da preferência dos espectroscopistas e baseia-se no seguinte esquema. Energia é proporcional a freqüência e freqüência é inversamente proporcional a comprimento de onda. Logo, energia é proporcional ao inverso de comprimento de onda. Merdindo o comprimento de onda em centímetros, a energia pode ser medida em inverso de centímetros (cm-1).
A espectroscopia Raman, os lasers e o físico brasileiro Sérgio Porto.
Em 1960 Theodore Maiman apresentou ao mundo o primeiro laser (veja a seção sobre lasers). Nesse mesmo ano, um físico brasileiro chamado Sérgio Pereira Porto chegava nos Estados Unidos para trabalhar no Laboratório Bell, um dos maiores centros de pesquisa aplicada do mundo.

Porto tinha se doutorado na Universidade John Hopkins e, desde então, cultivava um grande interesse pelo efeito Raman. Na época, essa técnica era limitada pela dificuldade na obtenção de uma boa e intensa fonte de luz monocromática. O brasileiro logo vislumbrou o enorme potencial dos lasers para suprir essa lacuna. Usou seu talento de experimentalista na melhoria dos dispositivos de deteção e dispersão dos equipamentos Raman e, com a utilização dos novos lasers passou a obter espectros de amostras sólidas com alta qualidade e resolução. Logo, seu laboratório se tornou lider nessa área de pesquisa.
Porto aplicou o efeito Raman ao estudo de inúmeras propriedades de sólidos, como polaritons em cristais, ondas de spin, sólidos desordenados e fonons oblíquos. Em 1967, foi trabalhar na Universidade da Califórnia do Sul e, finalmente, em 1972 voltou ao Brasil para ensinar e pesquinar na Universidade de Campinas, que desde essa época transformou-se em um dos mais importantes centros de pesquisa do Brasil.

Sérgio Porto morreu em 1979, aos 53 anos, enquanto participava de uma conferência sobre lasers em Novosiburk, na Sibéria da então União Soviética.
Porto foi um grande incentivador do grupo de espalhamento de luz do Departamento de Física da UFC, tendo, inclusive, participado da banca examinadora da primeira tese de pós-graduação do Departamento, que tratava da aplicação do efeito Raman ao estudo de transições de fase em cristais.
AUTORES:
Prof. Ilde Guedes.
Prof. José E. Moreira.

