O bafômetro
QUÍMICA
O BAFÔMETRO
Objetivo
Mostrar o funcionamento de um bafômetro através da oxidação do álcool comum(etanol).
Descrição
Sabe-se que, no momento em que se ingere bebidas alcoólicas, o etanol entra na circulação sangüínea e, ao passar pelos pulmões, uma parte do álcool é liberada através da respiração.
Desse modo, um motorista suspeito de dirigir após ingestão de bebidas alcoólicas apresentará, em sua respiração, uma quantidade de álcool proporcional à que ele teria ingerido.
Na pisseta, uma parte do álcool está no estado de vapor, e quando ela é apertada, esse vapor entra em contato com a solução de K2Cr2O7/H+. Dessa forma, a pisseta faz o mesmo papel dos pulmões.
Material
0,6 g de K2Cr2O7(s)(dicromato de potássio)
25 mL de H2SO4 concentrado (ácido sulfúrico)
50 mL de H2O (água destilada)
Béquer de 100mL ou um copo comum
tubos de ensaio
pisseta com um pouco de etanol no fundo
Procedimento
Prepare a solução da seguinte maneira:
* Dissolva o dicramato de potássio na água, e em seguida – com bastante cuidado – o ácido;
** Coloque uma pequena quantidade da solução num tubo de ensaio;
*** Nesse momento, introduza o bico da pisseta no tubo – sem encostá-lo na solução – e aperte a pisseta;
**** Agite o sistema;
***** Repita o procedimento até que a cor alaranjada inicial torne-se verde.
Análise
A solução K2Cr2O7/H+ é uma mistura oxidante que, ao reagir com o etanol, provocará sua oxidação a etanal e, até mesmo, a ácido acético, de acordo com a reação abaixo:
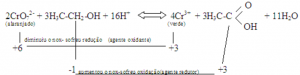
3) O cheiro característico do ácido acético é bastante perceptível no tubo de ensaio, após a reação.

